Las pruebas moleculares se están convirtiendo cada vez más en el nuevo estándar de atención al evaluar los nódulos tiroideos para detectar la presencia de cáncer.Esta metodología ahora se incluye en las recomendaciones de guías clínicas mundiales, incluidas las de la American Thyroid Association (ATA), National Comprehensive Cancer Network y UpToDate.
Como prueba adicional de la ubicuidad de las pruebas moleculares, no hay necesidad de buscar más allá de la reunión anual de la ATA de 2017 en Columbia Británica, donde casi 30 presentaciones cubrieron nuevos terrenos sobre este tema.
Valoración de los nódulos tiroideos indeterminados
La aplicación más común de las pruebas moleculares en la evaluación de nódulos tiroideos es guiar la atención de pacientes con nódulos indeterminados. El examen de citopatología de las biopsias por aspiración con aguja fina guiadas por ultrasonido (BAAF) es la herramienta estándar preoperatoria para evaluar los nódulos tiroideos de más de 1 cm. Sin embargo, en 15% al 30% de los aspirados de los nódulos, los resultados son indeterminados. Con base en el Sistema Bethesda para informar la citopatología tiroidea, los nódulos tiroideos indeterminados abarcan atipia de significado indeterminado / lesión folicular de significado indeterminado (AUS / FLUS; Bethesda categoría III); neoplasia folicular o sospechosa de neoplasia folicular (FN / SFN, Bethesda categoría IV); y sospechoso de malignidad (SM, Bethesda categoría V).
Los nódulos indeterminados tienen un riesgo suficientemente alto de cáncer como para justificar una evaluación adicional. Tradicionalmente, la mayoría de los pacientes con nódulos citológicamente indeterminados han sido referidos para cirugía de diagnóstico, aunque el 70% a 80% de estos nódulos finalmente resultan ser benignos por histopatología quirúrgica, lo que significa que la cirugía no era necesaria. Además, los pacientes con cáncer de tiroides confirmado pueden no recibir la cirugía que necesitan. Por ejemplo, Esfandiari et al informaron que más del 40% de los pacientes con cáncer de tiroides medular no se sometieron a una tiroidectomía total ni a una disección central del cuello, que este diagnóstico normalmente requeriría. Estos pacientes pueden requerir una segunda cirugía para “completar” la tiroidectomía.
La cirugía de tiroides puede tener un costo significativo para los pacientes, debido a su morbilidad, riesgos operativos y costos. Por lo tanto, la decisión de operar no debe tomarse a la ligera. Todos los casos de tiroidectomías y aproximadamente el 18% de las lobectomías tiroideas resultan en hipotiroidismo, que requiere el tratamiento de la hormona tiroidea de por vida con levotiroxina. Los pacientes con hipotiroidismo pueden desarrollar aumento de peso, fatiga y somnolencia, condiciones que pueden ser difíciles de controlar incluso con medicamentos. Además, los posibles efectos adversos de la terapia con hormona tiroidea incluyen arritmias cardíacas y pérdida de calcio, lo que aumenta el riesgo de osteopenia u osteoporosis. Algunos pacientes informaron que simplemente no se sentían bien después de extirpar la totalidad o parte de su tiroides. A esto se suman el costo psicológico de la mala salud y la inconveniencia de requerir visitas frecuentes de médicos.
El impacto financiero de las cirugías tiroideas también es significativo. En un análisis de datos de siniestros de seguros privados, Singer y col. Encontraron que el costo total de la cirugía tiroidea y el seguimiento clínico relacionado durante seis meses después de la cirugía fue de $ 21,371.9. Los costos de la salud desperdiciados se suman rápidamente cuando se considera que más de 100,000 pacientes pueden experimentar tal cirugía innecesariamente cada año. Estas limitaciones en la citopatología han llevado a la aparición de pruebas moleculares para proporcionar a los citopatólogos y tratar a los médicos con información de diagnóstico previamente indetectable sobre los nódulos tiroideos de los pacientes. Las pruebas basadas en estas tecnologías permiten a los médicos determinar mejor qué pacientes pueden evitar con seguridad la cirugía como parte de su diagnóstico y tomar mejores decisiones quirúrgicas para los pacientes que lo requieren. Teniendo en cuenta los riesgos, los daños y los costos asociados con la cirugía tiroidea y los sólidos datos que demuestran los beneficios de las pruebas moleculares en la evaluación del nódulo tiroideo, creo que su uso es simplemente lo correcto para los pacientes.
Descartar el cáncer de tiroides
Un objetivo principal de las pruebas moleculares de muestras indeterminadas de BAAF es identificar a los pacientes que pueden evitar una cirugía innecesaria, sin dejar e diagnosticar un cancer. Esto requiere que una prueba tenga una alta sensibilidad y, en consecuencia, un alto valor predictivo negativo (VPN). Hasta hace unos años, dicho uso de pruebas moleculares se limitaba principalmente a entornos académicos y las pruebas iniciales mostraron tasas de sensibilidad más bajas de lo deseado.
En 2011, la introducción comercial de un clasificador de 167 genes (Afirma® Gene Expression Classifier o GEC) que identificaba nódulos benignos entre aquellos considerados indeterminados por citopatología cambió la trayectoria de cómo se usan las pruebas moleculares en el diagnóstico de cáncer de tiroides. La prueba ahora está cubierta por Medicare y las aseguradoras privadas. El clasificador de 167 genes se realiza en muestras de pacientes que se recogen durante el procedimiento de BAAF inicial, lo que elimina la necesidad de que los pacientes se sometan a un procedimiento de BAAF de seguimiento. La prueba utiliza datos de expresión de ARNm obtenidos a través de análisis de microarrays y aprendizaje automático para identificar nódulos benignos entre los previamente clasificados como indeterminados.
En un estudio de validación clínica prospectivo ciego del clasificador genético en 49 sitios, Alexander et al determinaron que el clasificador tenía una sensibilidad del 92% y un VPN de 94% y 95% para AUS / FLUS y NF / SNF, respectivamente, entre los pacientes con una tasa de malignidad preestudio del 32%. Estas tasas son similares en precisión a las de un resultado de citopatología benigna. Los datos de utilidad clínica demostraron que el uso del clasificador de 167 genes cambió la atención del paciente según lo previsto. En un estudio multicéntrico, Duick et al demostraron que las cirugías entre pacientes con resultados GEC “benignos” se redujeron en un 90% (del 74% al 7.6%), en comparación con las tasas históricas de cirugía para pacientes con nódulos indeterminados.
Estudios adicionales demostraron la durabilidad de un resultado benigno de GEC, ya que los pacientes fueron seguidos clínicamente durante un período prolongado de tiempo y permanecieron libres de cáncer. Se han introducido clasificadores posteriores, que también combinan datos genómicos y aprendizaje automático para identificar nódulos benignos. Una prueba (RosettaGx Reveal) se realiza en un frotis de diapositiva de la biopsia BAAF inicial para evitar la necesidad de un tubo de recolección separado y otra BAAF. En un estudio de validación clínica, Lithwick-Yanai et al informaron que la prueba tenía una sensibilidad del 74% para los nódulos Bethesda III y IV. Otros datos publicados para esta prueba son limitados.
Tiene Cancer de tiroides
Las pruebas de mutación genética requieren examinar genes específicos para las alteraciones asociadas con el cáncer. A menudo incluye la prueba de BRAF y tres genes RAS para mutaciones puntuales específicas y pruebas para tres fusiones de genes: RET / PTC 1, RET / PTC3 y PAX8 / PPARG. Este tipo de prueba molecular se ha considerado principalmente como una prueba para confirmar cancer debido a su especificidad típicamente más alta para el cáncer, aunque con una sensibilidad más baja. En los nódulos tiroideos con citología indeterminada, la sensibilidad de esta prueba de panel mutacional de siete genes es variable, con informes que van del 36% al 100%.
De acuerdo con las guías ATA de 2015, la variabilidad informada en la sensibilidad del análisis mutacional con el panel de siete genes en nódulos indeterminados sugiere que los paneles de mutación de este tamaño pueden no descartar de manera confiable la malignidad con una prueba negativa en esta población. Al mismo tiempo, las pruebas moleculares solo deben usarse si los resultados cambiarán la toma de decisiones quirúrgicas. Dado que la mayoría de los pacientes con nódulos tiroideos indeterminados ya están dirigidos a cirugía, el uso de un panel de mutaciones que rige en cáncer solo cambiaría el tratamiento en los pocos pacientes que inicialmente se consideran para observación, o si el grado de cirugía se alteró debido al riesgo de cáncer asociado con la alteración genómica específica.
Una versión posterior de la prueba del panel de mutaciones (ThyroSeq® 2.1) incluye 56 genes y promete una gran precisión en la identificación de los nódulos cancerosos y benignos, lo que le permite controlar y descartar el cáncer. Estos hallazgos se basaron en estudios de un solo centro académico en los cuales el médico tratante y el histopatólogo no fueron cegados a algunos de los resultados moleculares. Una evaluación de Valderrabano et al concluyó que se necesitaban más estudios después de que su análisis demostrara una sensibilidad y especificidad significativamente menores para la prueba en comparación con los hallazgos iniciales de validación. Por ejemplo, en su evaluación, la sensibilidad de la prueba fue del 70%, lo que significa que omitió el 30% de los cánceres en el grupo de estudio. La noción de que la mutación no es igual a la malignidad, y viceversa, fue demostrada por Pagan et al. En este estudio, se utilizó un panel de 524 genes que abarca 851 variantes y 133 fusiones que se sabe están asociadas con el cáncer de tiroides para evaluar el nódulo tiroideo. Los investigadores encontraron que las alteraciones génicas aparecieron en solo el 50% de las muestras cancerosas (es decir, 50% de sensibilidad) y el 20% de las muestras benignas de tiroides albergaban alteraciones genéticas (es decir, 80% de especificidad). Estos hallazgos sugieren que la prueba carecía de precisión en descartar o no el cáncer porque las mutaciones genéticas se encontraron en muestras tanto benignas como malignas y, de manera similar, no estaban presentes en ambos tipos de muestras.
Avanzando en pruebas moleculares en pacientes con nódulos tiroideos
A medida que el campo continúa evolucionando, las pruebas moleculares se preparan para proporcionar información de diagnóstico aún más precisa y clínicamente valiosa para guiar el tratamiento apropiado para los pacientes con nódulos tiroideos.Además de refinar la capacidad de los médicos para resolver los nódulos tiroideos indeterminados, es probable que las pruebas moleculares aumenten en uso para informar la terapia óptima y medir la respuesta de la terapia, entre otros usos.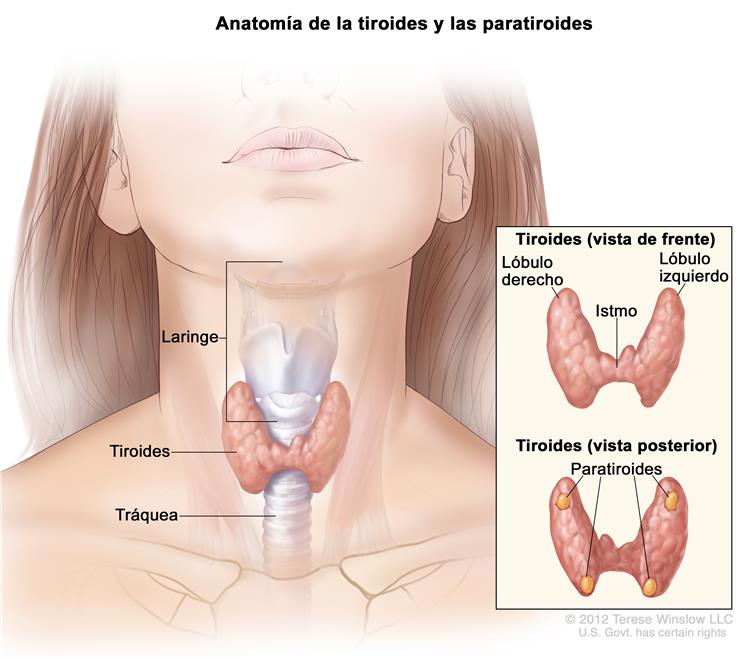
Rodrigo Arrangoiz es miembro del equipo de Sociedad Quirúrgica S.C., en donde nuestra prioridad y único interés es el bienestar de nuestros pacientes.
Rodrigo brinda una total dedicación al paciente para restablecer su estado de salud mediante el empleo de conocimientos médicos vigentes y técnicas de vanguardia cuya efectividad se ha demostrado científicamente. Más aún, corresponde a la confianza depositada en el al brindar tratamiento óptimo con ética y honestidad.
El entrenamiento de Rodrigo Arrangoiz MS, MD, FACS fue el siguiente:
-
Cirugia general y gastrointestinal:
-
-
Michigan State University:
-
-
Cirugia oncológica / tumores de cabeza y cuello / cirugia endocrina:
-
-
Fox Chase Cancer Center (Filadelfia):
-
-
Maestria en ciencias (Clinical research for health professionals):
-
-
Drexel University (Filadelfia):
-
-
Cirugia de tumores de cabeza y cuello / cirugia endocrina
-
-
IFHNOS / Memorial Sloan Kettering Cancer Center:
-
Published by Rodrigo Arrangoiz MS, MD, FACS, FSSO
My name is Rodrigo Arrangoiz I am a breast surgeon/ thyroid surgeon / parathyroid surgeon / head and neck surgeon / surgical oncologist that works at Center for Advanced Surgical Oncology in Miami, Florida.
I was trained as a surgeon at Michigan State University from (2005 to 2010) where I was a chief resident in 2010. My surgical oncology and head and neck training was performed at the Fox Chase Cancer Center in Philadelphia from 2010 to 2012. At the same time I underwent a masters in science (Clinical research for health professionals) at the University of Drexel. Through the International Federation of Head and Neck Societies / Memorial Sloan Kettering Cancer Center I performed a two year head and neck surgery and oncology / endocrine fellowship that ended in 2016.
Mi nombre es Rodrigo Arrangoiz, soy cirujano oncólogo / cirujano de tumores de cabeza y cuello / cirujano endocrino que trabaja Center for Advanced Surgical Oncology en Miami, Florida.
Fui entrenado como cirujano en Michigan State University (2005 a 2010 ) donde fui jefe de residentes en 2010. Mi formación en oncología quirúrgica y e n tumores de cabeza y cuello se realizó en el Fox Chase Cancer Center en Filadelfia de 2010 a 2012. Al mismo tiempo, me sometí a una maestría en ciencias (investigación clínica para profesionales de la salud) en la Universidad de Drexel. A través de la Federación Internacional de Sociedades de Cabeza y Cuello / Memorial Sloan Kettering Cancer Center realicé una sub especialidad en cirugía de cabeza y cuello / cirugia endocrina de dos años que terminó en 2016.
View all posts by Rodrigo Arrangoiz MS, MD, FACS, FSSO






